Choroba przeszczep przeciwko gospodarzowi
Choroba przeszczep przeciwko gospodarzowi (ang. Graft-Versus-Host Disease, GvHD) jest jednym z najczęściej występujących powikłań po przeszczepieniu allogenicznych komórek krwiotwórczych (alloHTC). Stanowi zagrożenie życia dla około 25 do 50% pacjentów. Choroba zwyczajowo jest leczona za pomocą leków sterydowych, jednak w 40-60% przypadkach obserwuje się sterydooporność lub sterydozależność. Naukowcy w ciągu ostatnich lat udowadniali, że przeszczepienie mikrobioty jelitowej (ang. fecal microbiota transplantation, FMT) może być nowoczesną i obiecującą terapią, ze względu na immunomodulujący potencjał mikrobioty jelitowej.
Patogeneza choroby
Choroba rozpoczyna się od aktywacji limfocytów T pochodzących z materiału przeszczepionego od dawcy, które rozpoznają tkanki biorcy jako obce i prowadzą do ich zniszczenia. Organizm biorcy w reakcji na zniszczenia zaczyna wytwarzać cytokiny prozapalne (m.in. TNF-alfa, IL-1, IL-6), sygnalizując i rozpoczynając proces zapalny. Powoduje to napływ komórek prezentujących antygen biorcy, potęgując równocześnie działanie limfocytów T dawcy. Największemu zniszczeniu ulegają komórki Panetha i komórki kubkowe obecne w układzie pokarmowym. Komórki kubkowe wydzielają mucynę, która oddziela bakterie znajdujące się w świetle jelita od komórek nabłonkowych, zapewniając integralność bariery jelitowej. Błona śluzowa układu pokarmowego odgrywa ogromną rolę w ochronie organizmu przed wnikaniem do niego zagrożeń ze środowiska zewnętrznego. Komórki Panetha są odpowiedzialne za wydzielanie alfa defensyn, które są peptydami przeciwdrobnoustrojowymi utrzymującymi odpowiednią równowagę w składzie mikrobioty jelitowej. Zniszczenie tych komórek przekłada się na utratę stanu eubiozy w jelicie. Ponadto szczególną rolę odgrywa GALT (ang. gut-associated limfoid tissue), czyli tkanka limfatyczna związana z układem pokarmowym, stanowiąca rezerwuar komórek układu immunologicznego – limfocytów. Integralność i ciągłość struktury ścian jelitowych zostaje naruszona, a to pozwala bakteriom i patogenom bezpośrednio przedostawać się do krwioobiegu i narządów, narażając pacjenta na rozwój sepsy. Powstaje błędne koło, w którym przez nasilone wydzielanie cytokin prozapalnych biorcy, postępuje rozwój choroby i udział limfocytów T dawcy. Limfocyty T cytotoksyczne wnikają do narządów, w szczególności do wątroby, układu pokarmowego i skóry.
Rola mikrobioty jelitowej
W ostatnich latach powstaje coraz więcej doniesień, że dysbioza jelitowa jest czynnikiem ryzyka wielu chorób, w tym również GvHD. Zmniejszona różnorodność bakterii w jelicie prowadzi do mniejszej przeżywalności choroby i zwiększonego ryzyka GvHD. Stan dysbiozy predysponuje pacjenta do kolonizacji bakteriami antybiotykoopornymi (ARB), które podczas infekcji znacznie podwyższają ryzyko zgonu pacjenta. Kolonizacja ARB została uznana za czynnik ryzyka rozwinięcia choroby przeszczep przeciwko gospodarzowi oraz innych powikłań po przeszczepieniu komórek krwiotwórczych. Zdrowa i różnorodna mikrobiota jelitowa zapobiega wnikaniu patogennym szczepom bakterii, wypierając ich ze swojego środowiska na zasadzie konkurencji.
W literaturze wymienia się wiele szczepów lub rodzajów bakterii, które mogą przyczyniać się do obniżenia lub zwiększenia ryzyka rozwoju choroby. Pośród nich wyróżnia się rodzaj Clostridiales, który produkuje krótkołańcuchowe kwasy tłuszczowe (ang. short-chain fatty acids, SCFA). Kwas masłowy należący do SCFA wykazuje korzystne działanie odżywcze na enterocyty (komórki nabłonka jelita) oraz wspomaga integralność ścian, hamuje apoptozę, przez co zmniejsza objawy GvHD. Z drugiej strony, obecność w dużej ilości np. Enterococcus lub Akkermansia muciniphila może predysponować do zaostrzenia przebiegu choroby i wpływać na mniejsze rokowanie pacjentów.
Naukowcy uważają, że oznaczanie kompozycji mikrobioty jelitowej podczas przeszczepiania szpiku, pozwoliłoby na odpowiednio wczesne wprowadzanie leczenia i zapobieganie powikłań u pacjentów z predyspozycją do rozwinięcia GvHD. Pacjenci stosując antybiotyki i inne leczenie po przeszczepie szpiku są wysoce narażeni na zmniejszenie różnorodności bakterii w jelicie, a zniszczenia komórek Panetha dodatkowo umożliwiają rozwój potencjalnie szkodliwych bakterii, w tym antybiotykoopornych, komplikując leczenie.
Leczenie GvHD
Terapią pierwszego rzutu są leki sterydowe, jednak aż 35-50% pacjentów wykazuje oporność na leczenie. Nie ustanowiono terapii drugiego rzutu, najlepiej udokumentowane jest leczenie ruksolitynibem. Inne terapie, takie jak fotofereza pozaustrojowa (ECP), sirolimus, przeciwciała anty-TNF, mykofenolan mofetylu, przeciwciała anty-IL-2R, metotreksat, alemtuzumab i globulina antytymocytowa, są mniej skuteczne lub mniej zbadane. Ponadto naukowcy badają działanie alfa1-antytrypsyny, mieszaniny anty-CD3 i anty-CD7 przeciwciał sprzężonych z rekombinowaną rycyną A i wedolizumabu. Wśród terapii, których działanie nie wykazało pozytywnych efektów jest stosowanie czynników takich jak brentuksymab vedotin i begelomab.
FMT w GvHD
Część metod leczenia nadal jest przedmiotem badań naukowców. Jedną z nich jest przeszczepienie mikrobioty jelitowej (FMT), ze względu na udowodnione oddziaływanie mikrobioty z układem immunologicznym oraz, wspomniany wcześniej, pozytywny wpływ na utrzymanie intergalności bariery jelitowej. FMT przyczynia się do zwiększenia różnorodności bakterii, w szczególności tych produkujących krótkołańcuchowe kwasy tłuszczowe. Przeszczepienie mikrobioty jelitowej może znacznie poprawić rokowania pacjenta, przywracając odpowiednią bioróżnorodność, co przekłada się na zredukowane ryzyko infekcji i zgonów. Jesteśmy jednymi z liderów w tym temacie na świecie, nasze dane wskazują na skuteczność FMT w stosowaniu u pacjentów z GvHD na poziomie 50% u chorych, którzy mają bardzo złe rokowanie. Może to oznaczać przełom.
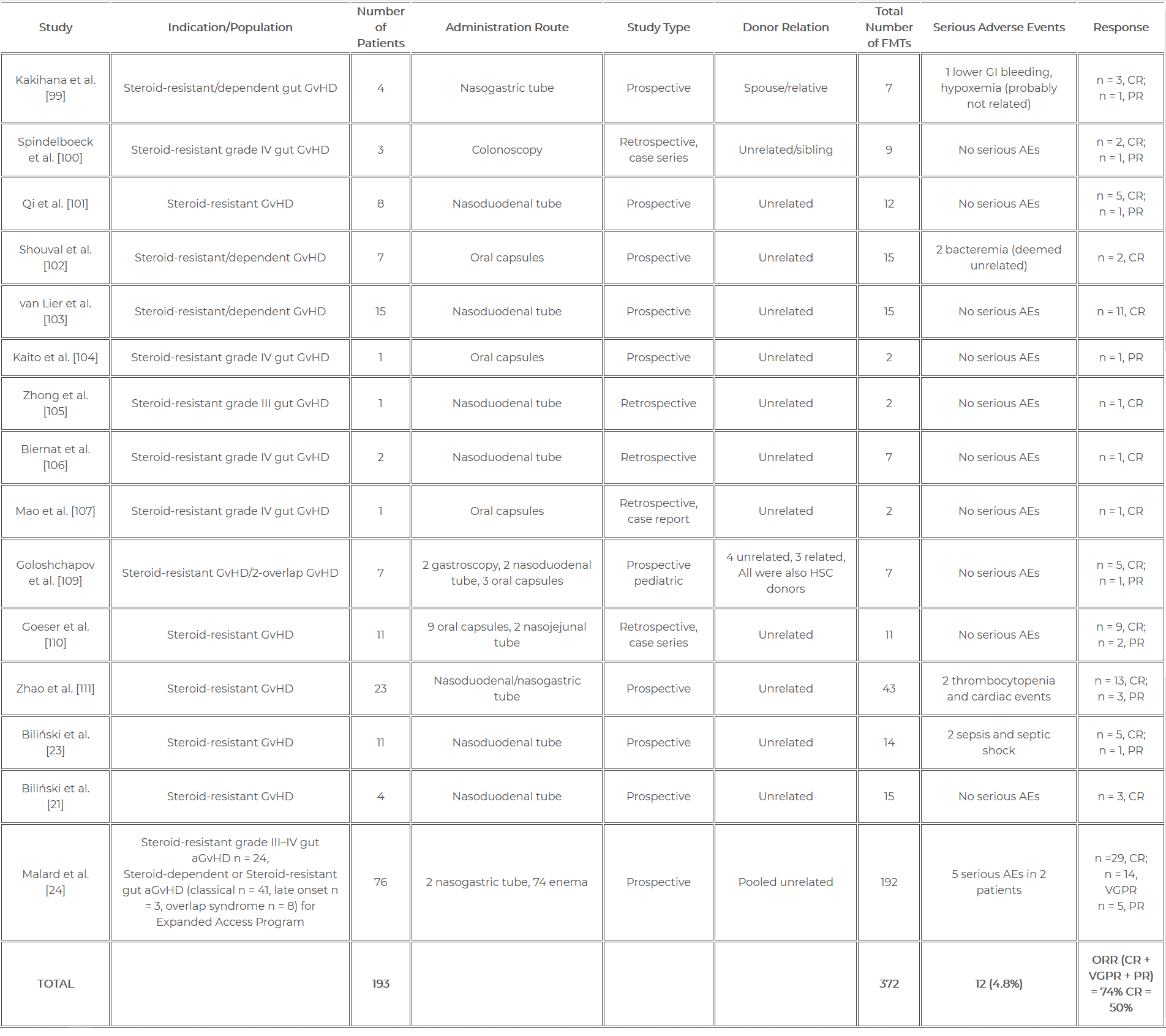
W naszej najnowszej pracy poglądowej (LINK) podsumowaliśmy wszystkie doniesienia jakie się do tej pory ukazały. Według najświeższych danych FMT przeprowadzono u niemal 200 pacjentów z GvHD, wykonując 372 zabiegi. Wykazano, że odpowiedź na leczenie FMT w przebiegu GvHD może sięgać nawet do 74%. Ze względu na wysoką efektywność oraz bezpieczeństwo (4,8% działań niepożądanych), badacze liczą, że FMT w przyszłości może stać się standardem leczenia GvHD.
Zestawienie badań klinicznych dotyczących FMT przeprowadzonego w przebiegu leczenia choroby przeszczep przeciwko gospodarzowi zostało przedstawione w Tabeli 1.
Źródła
Biliński J, Jasiński M, Basak GW. The Role of Fecal Microbiota Transplantation in the Treatment of Acute Graft-versus-Host Disease. Biomedicines. 2022 Apr 1;10(4):837. doi: 10.3390/biomedicines10040837. PMID: 35453587; PMCID: PMC9027325.

